(dott. Andrea Setti)
In questo articolo continuerò l’analisi della pubblicazione dell’EMA (European Medicines Agency) del 2019: “Categorisation of antibiotics in the European Union - Answer to the request from the European Commission for updating the scientific advice on the impact on public health and animal health of the use of antibiotics in animals– EMA 2019” (qui il link al precedente intervento).
La categoria A ("Evitare") corrisponde alla categoria 3 nel primo rapporto AMEG e comprende le classi di antibiotici non autorizzate in medicina veterinaria ma autorizzate in medicina umana nell'UE. Queste classi possono essere utilizzate eccezionalmente in animali non destinati alla produzione alimentare in conformità con la "cascata"[1] prescrittiva. Nel caso di animali destinati alla produzione alimentare, queste sostanze non possono essere utilizzate ai sensi della "cascata" prescrittiva in assenza di limiti massimi di residui stabiliti. Per impostazione predefinita, qualsiasi nuova sostanza antibiotica autorizzata per l'uso nella medicina umana dopo la pubblicazione della categorizzazione sarà provvisoriamente inclusa nella categoria A indipendentemente dalla categorizzazione della sua (sotto) classe madre.
La categoria B ("Limitare") corrisponde alla categoria 2 nel primo rapporto AMEG, comprese le sostanze elencate come CIA (HPCIA) a massima priorità dall'OMS, ad eccezione dei macrolidi e quelle classi incluse nella categoria A. Pertanto, questa categoria include i chinoloni[2], Cefalosporine e polimixine di terza e quarta generazione. Per questi antibiotici, il rischio per la salute pubblica derivante dall'uso veterinario deve essere mitigato da restrizioni specifiche.
Questi antibiotici limitati dovrebbero essere usati per il trattamento di condizioni cliniche quando non esistono antibiotici alternativi in una categoria inferiore che potrebbero essere clinicamente efficaci. Soprattutto per questa categoria, l'uso dovrebbe essere basato sui risultati dei test di sensibilità agli antibiotici, quando possibile.
Nel primo parere scientifico AMEG (EMA / AMEG, 2014), gli aminoglicosidi e la sottoclasse di penicilline, aminopenicilline, sono stati temporaneamente inseriti nella Categoria 2, in attesa di una profilazione del rischio più approfondita. I documenti di riflessione del comitato per i medicinali per uso veterinario (CVMP) sugli aminoglicosidi (EMA / CVMP / AWP, 2018b) e le aminopenicilline (EMA / CVMP / AWP, 2019, DRAFT) riconoscono che in conformità con i criteri di categorizzazione del primo Rapporto AMEG, tutti gli aminoglicosidi veterinari autorizzati e le combinazioni amoxicillina-clavulanato sarebbero inseriti nella categoria 2. Tuttavia, poiché si è ritenuto che l'uso di questi antibiotici in medicina veterinaria presentasse un rischio inferiore per la salute umana rispetto ai chinoloni e alle cefalosporine di terza e quarta generazione, il CVMP ha raccomandato di prendere in considerazione un'ulteriore stratificazione della categorizzazione AMEG originale. Inoltre, è stato suggerito che l'aggiunta di una categoria intermedia migliorerebbe l'utilità della categorizzazione come strumento di gestione del rischio, evitando il risultato controproducente che troppi antibiotici vengano inseriti nella categoria a rischio più elevato.
La categoria C ("Attenzione") è stata aggiunta come categoria intermedia, tenendo conto delle considerazioni di cui sopra. Questa categoria comprende singole classi di antibiotici elencate in diverse categorie dall'OMS, inclusi i macrolidi HPCIA. Per quelle sostanze proposte per l'inclusione in questa categoria, ci sono in generale alternative nella medicina umana nell'UE, ma ci sono poche alternative nella medicina veterinaria per alcune indicazioni.
Anche le classi di antibiotici che possono selezionare la resistenza a una sostanza nella categoria A attraverso specifici geni multiresistenza sono state inserite in questa categoria.
Questi antibiotici dovrebbero essere usati solo quando non ci sono sostanze disponibili nella categoria D che sarebbero clinicamente efficaci.
La categoria D ("Prudenza") è la categoria di rischio più basso. Mentre il rischio per la salute pubblica associato all'uso in medicina veterinaria di sostanze incluse in questa categoria è considerato basso, un certo numero di sostanze in questa categoria sono elencate come CIA dell'OMS (aminopenicilline, penicilline naturali e isoxazolilpenicillina). È riconosciuto che questi antibiotici non sono privi di impatto negativo sullo sviluppo e sulla diffusione della resistenza, in particolare attraverso la co-selezione. Pertanto, sebbene non vi siano raccomandazioni specifiche per evitare l'uso di sostanze di categoria D, vi è una raccomandazione generale secondo cui i principi di uso prudente dovrebbero essere rispettati nella pratica quotidiana per mantenere il rischio dell'uso di queste classi il più basso possibile. L'uso inutile e i periodi di trattamento inutilmente lunghi dovrebbero essere evitati e il trattamento di gruppo dovrebbe essere limitato a situazioni in cui il trattamento individuale non è fattibile.
Le misure di gestione dei rischi applicate alle singole categorie AMEG dovrebbero essere considerate complementari alle disposizioni del regolamento (UE) 2019/6 sui medicinali veterinari (Gazzetta ufficiale dell'Unione europea, 2019) in relazione all'uso di antibiotici per la profilassi, metafilassi e sotto la "cascata".
L'AMEG ha anche considerato la via di somministrazione come un ulteriore criterio per affinare la categorizzazione. A causa della complessità, data la varietà di combinazioni di formulazione/classe antibiotica autorizzate per le diverse specie animali e condizioni di allevamento in Europa, è stato deciso di introdurre la via di somministrazione come elenco separato. L'elenco seguente suggerisce le vie di somministrazione e i tipi di formulazione indicati in ordine generale di preferenza in termini di impatto stimato sulla selezione di AMR. L'elenco dovrebbe essere usato insieme alla categorizzazione quando si tiene conto dell'AMR nelle decisioni di prescrizione:
• trattamento individuale locale (ad es. siringa intramammaria, collirio, o gocce auricolari);
• trattamento individuale parenterale (per via endovenosa, intramuscolare, sottocutanea);
• trattamento individuale orale (cioè compresse, bolo orale);
• farmaci iniettabili di gruppo (metafilassi), solo se adeguatamente giustificati;
• medicazione orale di massa mediante acqua d’abbeverata/sostituti del latte (metafilassi), solo se adeguatamente giustificati;
• medicazione orale di massa mediante mangimi/premiscele (EMA / EFSA, 2017) (metafilassi), solo se adeguatamente giustificati.
Questa categorizzazione non si traduce direttamente in linee guida di trattamento per l'uso di antibiotici in medicina veterinaria, ma può essere utilizzata come strumento da coloro che preparano le linee guida, per prendere decisioni sulla prescrizione sotto la "cascata" o quando decidono le attività di mitigazione del rischio. Nella medicina veterinaria, la varietà di specie animali, le diverse vie di somministrazione (dal trattamento intramammario delle singole vacche al trattamento di molte centinaia di polli da carne mediante il trattamento dell'acqua di bevanda) e la diversità delle indicazioni sono tutti fattori che devono essere presi in considerazione per la redazione di linee guida per il trattamento. Inoltre, i differenti sistemi di produzione, la presenza di diverse malattie e l'insorgenza di resistenza antimicrobica possono differire tra le regioni. Pertanto, le linee guida per il trattamento devono essere sviluppate e implementate a livello nazionale, regionale o persino locale. Sono incoraggiati lo sviluppo e l'attuazione di linee guida di trattamento nazionali e regionali basate sull'evidenza.
Si raccomanda di rivedere questa categorizzazione alla luce dei dati raccolti ogni anno nel programma obbligatorio di monitoraggio EFSA / ECDC per la resistenza antimicrobica nei batteri zoonotici e indicatori (e almeno entro 5 anni) e, se necessario, sulla base di nuovi prove scientifiche ad hoc o informazioni emergenti sul cambiamento dei modelli di uso di antibiotici e/o tendenze di resistenza.
Di seguito viene fornita una tabella riepilogativa (click sull'immagine per ingrandirla in finestra separata) che specifica la categorizzazione per ciascuna classe o sottoclasse di antimicrobici.
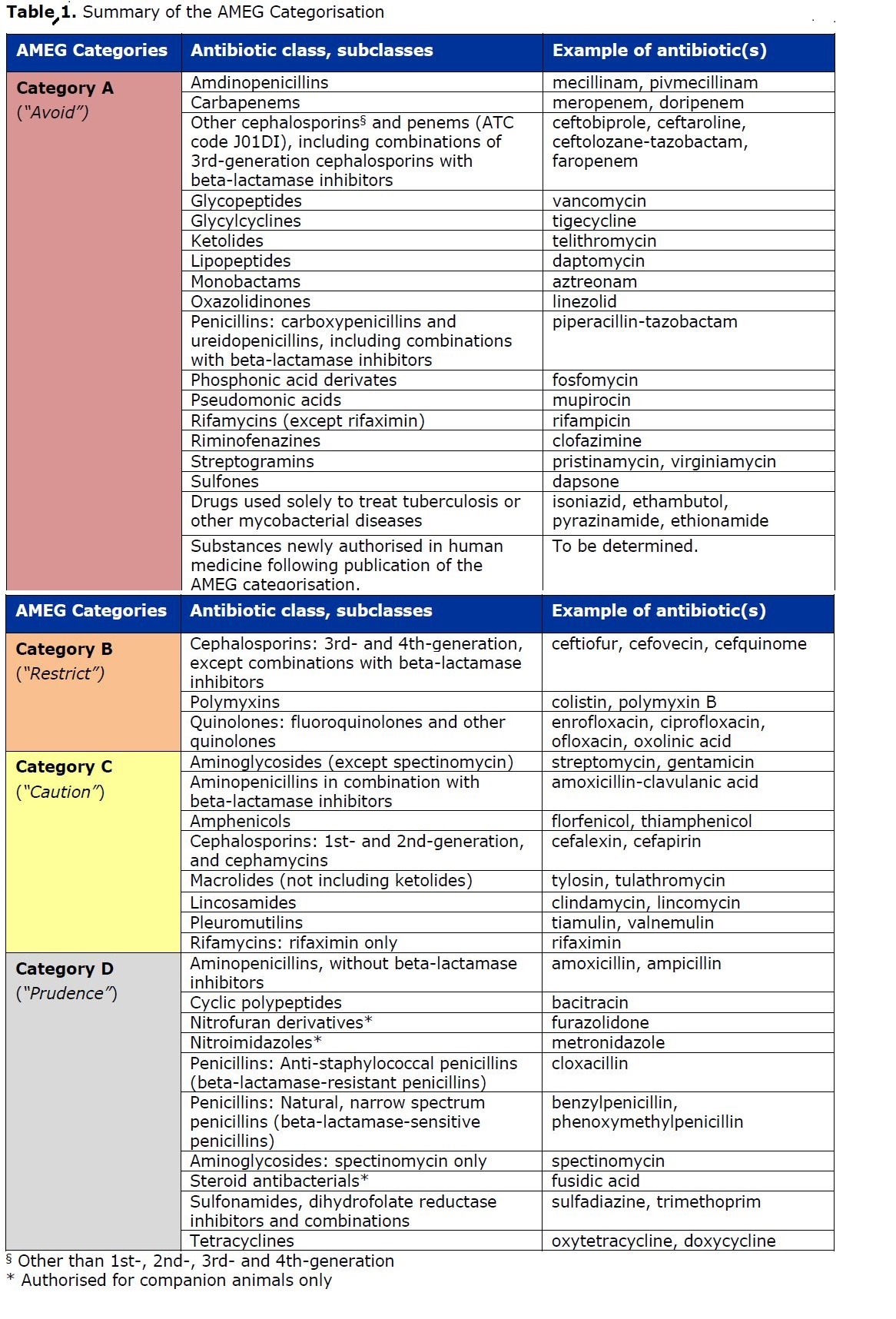
La classificazione delle classi di antibiotici per uso veterinario nell'UE, con esempi di sostanze attive per classe, è presentata nell'infografica disponibile sul sito web dell'EMA. È inoltre incluso un elenco delle vie di somministrazione e dei tipi di formulazione in ordine di preferenza in termini di impatto stimato sulla resistenza antimicrobica. I veterinari sono incoraggiati a consultare questa infografica come fonte di informazioni al momento di decidere quale antibiotico prescrivere agli animali.
Nei prossimi lavori porterò a termine l’analisi della pubblicazione dell’EMA.
Si ringrazia il GDL Farmaco FNOVI
[1] Articoli 10 e 11 della direttiva 2001/82 / CE e articoli 107, 112, 113 e 114 del regolamento (CE) 2019/6. La legislazione include disposizioni che, quando non è disponibile un prodotto autorizzato idoneo e in circostanze eccezionali, consentono a un veterinario di utilizzare un medicinale veterinario al di fuori delle sue condizioni d'uso autorizzate o di utilizzare un medicinale non autorizzato, secondo determinati criteri: la "cascata" . Le singole sostanze che non sono autorizzate per l'uso in un medicinale veterinario ma che rientrano nelle (sotto) classi di antibiotici incluse nelle categorie B, C o D (ad es. Azitromicina, che appartiene alla classe dei macrolidi) possono anche essere somministrate solo in “cascata”.
[2] Chinoloni: fluorochinoloni e altri chinoloni.